前言
过去的糖尿病治疗存在众多桎梏:外源胰岛素只能补偿缺口,却无法真正恢复身体自身的调控能力;而干细胞来源的 β 细胞替代疗法虽然令人期待,却又受制于因为免疫排斥、移植风险和高昂的细胞制造成本等难题,难以广泛应用。
让身体重新“学习”分泌胰岛素,是治标治本的理想方案。而最近,一个出乎意料的新希望,来自于胃。
在人类的胃黏膜中,存在一类具有可塑性的祖细胞:胃上皮前体细胞。它们和分泌胰岛素的胰腺 β 细胞同属消化道,都源自内胚层谱系,在发育初期存在一段高度重叠的基因表达窗口,共享可被重新激活的潜在分化程序。这意味着胃上皮细胞并非完全锁死在消化功能上,如果存在合适的分子信号,其同样具备向胰腺样命运转化的可能。
2025年11月6日,哈佛大学、北京大学及康奈尔医学院团队合作,在期刊Stem Cell Reports发表论文“Modeling in vivo induction of gastric insulin-secreting cells using transplanted human stomach organoids”,对此首次给出了明确的人源证据。他们将来自人类胚胎干细胞(ESC)的胃类器官(hGOs)移植到小鼠体内,6个月后,通过多西环素(DOX)成功诱导出功能性胰岛β细胞(占总移植体60%),并在糖尿病小鼠中实现了显著的血糖改善。整个流程无胰腺来源、无需免疫抑制、且保留了胃上皮自我更新区,为“自体原位重编程”提供了可放大的类器官范式。
事实上,在过去几年间,同一团队已经在小鼠模型中展示过“胃细胞重编程为胃源胰岛素分泌细胞(GINS)”的可能性。但这些工作多数仍停留在小鼠胃的重编程水平,无法回答最关键的问题——人类胃细胞是否也具备这种可塑性。而本研究中,他们使用了完全来自于人类细胞、在体外自组织而成的3D人源胃类器官,该模型具备与人胃相近的细胞和分子特性,能反映人类胃的真实发育和可塑性,从而首次证明,人类胃上皮前体细胞同样具备重编程为胰岛 β 细胞的潜能。
本研究不仅重新定义了胃在内分泌再生中的可能角色,也为未来自体化、低免疫风险的糖尿病治疗揭开了全新的器官选项。

01 为什么选择胃?——背景与策略设计
胰腺与胃同源于前肠,细胞命运在胚胎发育中受到一系列转录因子的调控,包括 PDX1、SOX9、NKX2-2 等。胃窦区域尤其富含上皮干/祖细胞,具有更高的可塑性。研究者发现,只要施加合适的重编程信号,胃上皮能“向后回溯”,重新激活胰腺样基因程序。
这意味着胃来源细胞有天然的可重塑性,同时胃取材相对安全,组织再生快,便于未来实现自体细胞治疗。因此,胃类器官成为验证“人类胃组织能否产胰岛素”的最关键模型。
有鉴于此,他们决定采用“人胃类器官先移植-后重编程”的策略,把待验证的问题拆成三步:能否长期驻留?能否在体被诱导?能否逆转高血糖?
02 人类胃类器官的培养与移植方案
为了让人源胃类器官(hGOs)在体内能够被“按需”转向胰腺样命运,研究团队在分化前,就为胚胎干细胞(ESC)安装了一套可控的重编程开关。其核心是 NEUROG3、PDX1 和 MAFA 这三个决定胰腺内分泌命运的关键转录因子(统称NPM),它们被装进一个带有 Tet-On 开关的基因模块中,并通过 CRISPR 精准整合到ESC基因组的 AAVS1 安全位点(人类基因组中不会干扰关键基因的位点)。
这样,类器官里的细胞在生长和成熟过程中不会主动表达 NPM,直到研究者在移植小鼠体内后给予多西环素(DOX),Tet-On 系统被激活,NPM 才开始同步表达,诱导能够分泌胰岛素的 β 样命运。
在体外生成成熟、结构完整的人胃类器官
接下来,研究团队采用经典四阶段方案:最初三天以 Activin A 诱导胚胎干细胞进入内胚层;随后连续加入 CHIR99021、FGF4、Noggin,并在第三天补充视黄酸,使其进一步被模式化为后前肠,随后包埋入三维 基质胶中,继续在视黄酸、Noggin 与 EGF 的组合刺激下被引导至胃窦命运;历经约 30 天的逐步诱导与三维扩增,最终形成结构清晰的 NMP-hGOs。
获得的类器官包含上皮层与间质层,具备黏液细胞、内分泌细胞与胃上皮前体细胞(如SOX9⁺ 胃祖细胞)等多类胃窦特征细胞,稳定表达 MUC5AC、SOX9、PDX1 等标志基因,整体形态与人类胃窦高度相似。
这一步至关重要,因为只有包含正确细胞谱系的类器官,才有可能响应后续重编程信号。
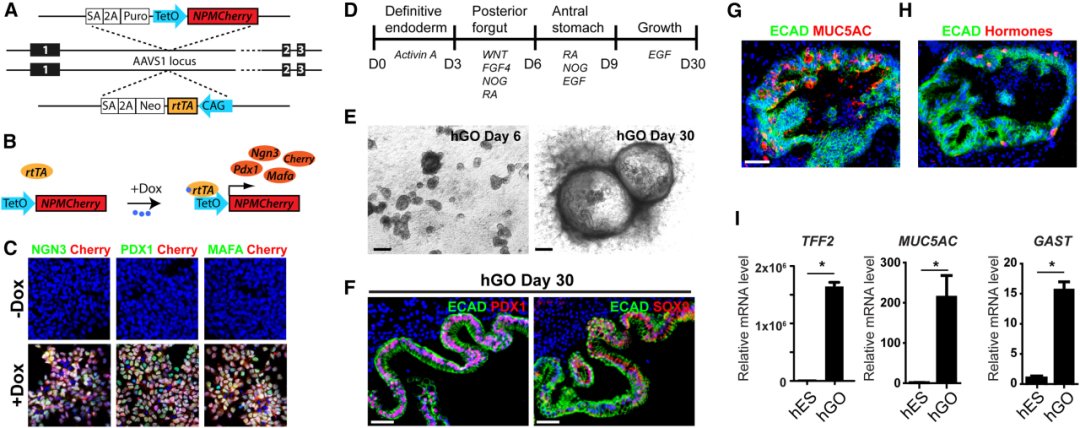
图:从hESCs生成hGOs
将类器官移植入免疫缺陷小鼠
移植入小鼠睾丸脂肪垫后,NPM-hGOs可稳定生长达 6 个月,无异常增殖,无畸胎瘤,并进一步分化为酸性、黏液性、分泌肽类的高度成熟胃上皮,呈现出高度拟真的胃窦组织形态,并保持着继续分化的能力。
这是第一次系统确认:人类胃类器官可以在体内长时间维持其生理结构,并保持重编程所需的干/祖细胞库。
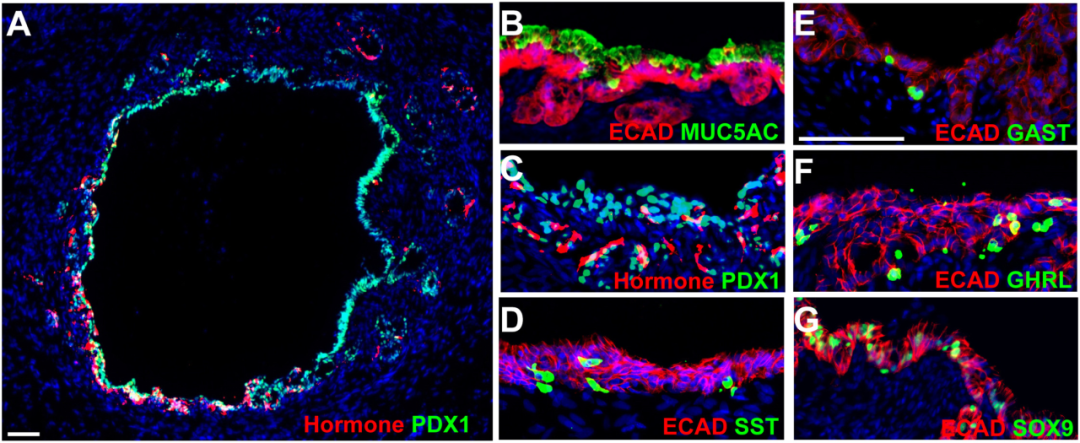
图:hGOs可以移植并在小鼠体内长期维持
03 人类胃类器官重编程为控糖的GINS细胞
体内激活重编程因子,胃类器官开始分泌胰岛素
接下来,研究团队给移植小鼠喂食 DOX 触发 NPM 表达,结果发现原本“专注消化”的胃上皮细胞开始迅速转向胰岛素样命运,观察到大量分泌胰岛素的细胞(GINS)出现在类器官上皮中,且这些细胞表达关键 β 细胞标志(PCSK1、MAFB、PAX6、NKX2-2),并与周围 PECAM1 阳性的血管网络紧密贴合,具备把胰岛素向基底侧分泌、释放到血液循环中的结构条件。胃黏膜天然具有向胃腔分泌胃酸等和向血液循环分泌激素、肽类等的两种分泌方向,研究同样在小鼠血清中检测到人源胰岛素,证明胰岛素可以通过进入血液循环,避免在胃中的消化分解。
单细胞测序显示,60% 以上的移植 NMP-hGOs 中出现了密集的 GINS 细胞。且这些被重编程的细胞不仅在基因表达上接近 β 细胞,还呈现出成熟 β 细胞才具备的代谢和分泌路径,说明这并非简单的“胰岛素阳性染色”,而是真实具备功能的β样细胞群体。
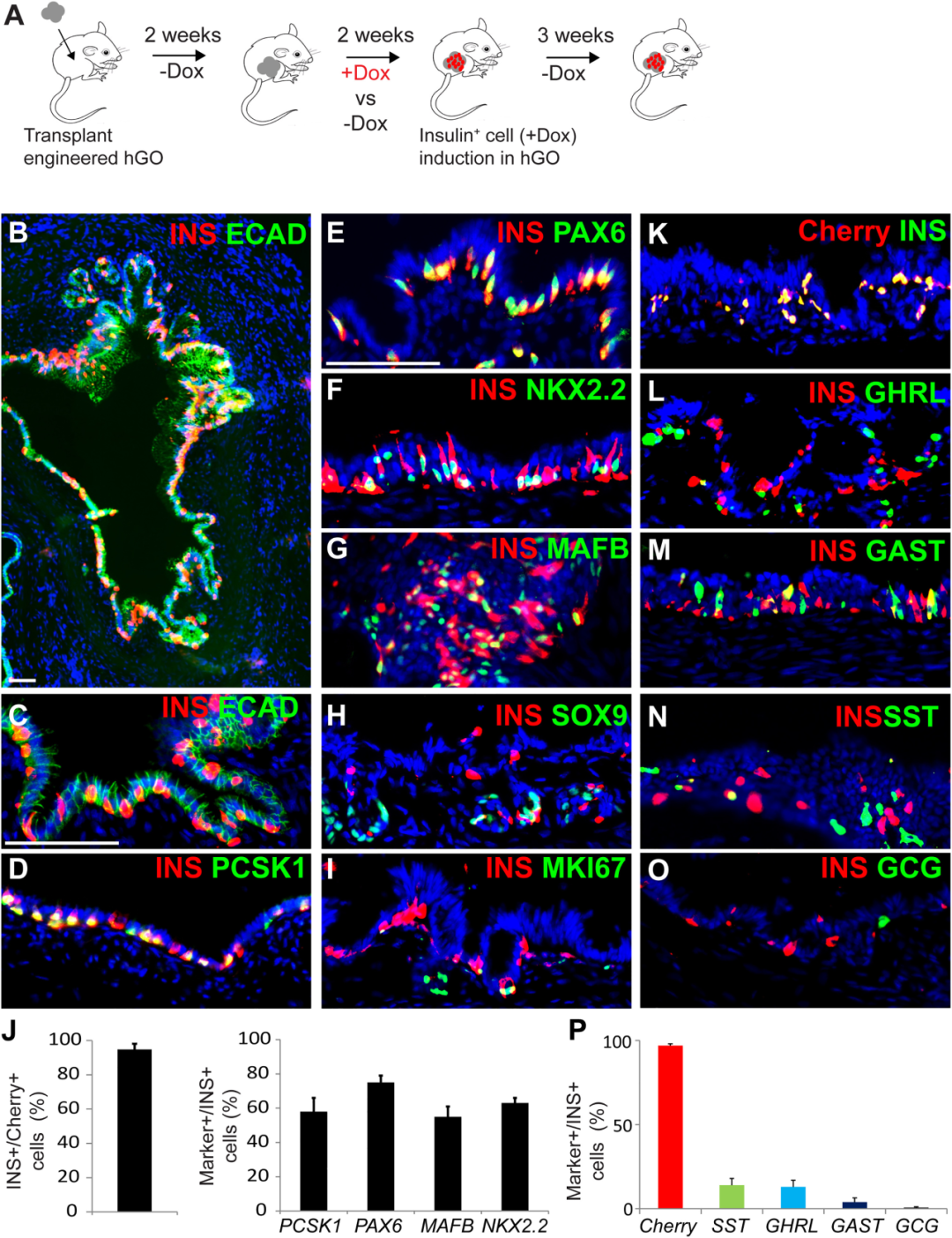
图:NPM-hGOs可在体内生成GINS细胞
功能验证
在 STZ 糖尿病模型中,给予 DOX 的移植了NPM-hGOs的小鼠出现快速而持续的血糖下降,并在葡萄糖耐量实验中表现明显改善。血液中可检测到人源胰岛素,这证明了类器官产生的胰岛素成功进入循环。
总而言之,研究团队成功在体内将胃类器官“逆命运重编程”,变成可控糖的胰岛素细胞来源。
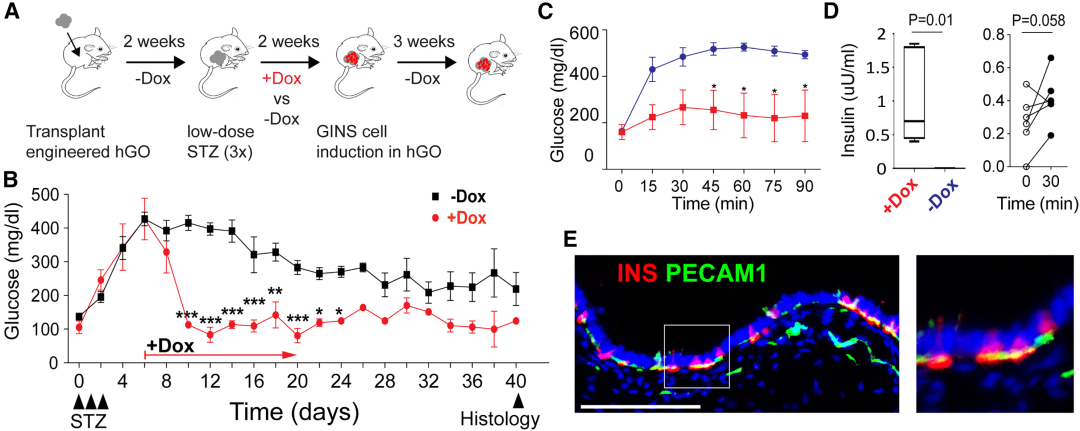
图:移植的NPM-hGOs分泌胰岛素并改善实验性糖尿病
04 该研究的突破性意义
研究团队通过基因编辑的ESC诱导培养hGOs,移植小鼠后成功诱导了向GINS的命运转化,对前文提出的三个问题:能否长期驻留?能否在体被诱导?能否逆转高血糖?均给出了肯定的解答。
这项研究最具颠覆性的意义在于,它提出了一条完全不同于传统细胞治疗的道路:
有望成为真正的“自体细胞疗法”来源
未来若能从患者自身取胃黏膜细胞,扩增成胃类器官,再在体内重编程,就能绕过他体免疫排斥、长期免疫抑制以及专一化生产流程的高成本与瓶颈。换句话说,患者自己的胃组织,有可能变成自己的胰岛β细胞来源,直接生产胰岛素进入血液循环,从而降低血糖、改善葡萄糖耐量。
更重要的是,胃黏膜是人体最容易采集、再生能力最强、可扩增性上皮组织之一,取材比胰腺活检安全一万倍,且胃上皮每 3–7 天整体更新一次,提供了丰富的重编程原材料。如果未来能直接取患者自身的胃细胞,扩增成胃类器官,再通过合适的分子递送方式在体内进行重编程,那么胰岛素细胞的来源将不再依赖供体。
体内重编程避免了“干细胞批次变异”问题
hiPSC 的制备与分化存在不可控批间差异,导致各实验室难以获得一致的 β 细胞功能。而胃类器官在体内环境中更加稳定、成熟度更高,能减少“器官在培养皿里不成熟”的问题。
05 与临床的距离
尽管成果令人振奋,但研究者也在论文中强调了几个现实挑战。
首先,当前仍依赖基因编辑(CRISPR)与药物诱导,不适合直接用于人体。未来或可开发mRNA药物、AAV 靶向递送或肽/小分子替代重编程因子等方案,以达到“在人体胃黏膜局部注射即可诱导”的安全方案。
其次,目前的胃类器官未形成胰岛状结构,而是散在的 β 样细胞。尽管在动物模型中,散在的 β 样细胞仍然能改善血糖,但人体中是否需要更结构化的“微胰岛”,尚未可知。不过过去的研究显示,重编程的细胞可能随着时间自行聚集成岛状结构,这为未来留出空间。
其三,自体细胞重编程无法回避 1 型糖尿病的自身免疫问题。即便是利用患者自身的组织重建 β 样细胞,依旧存在成为免疫系统攻击靶点的可能。这意味着未来仍可能需要局部免疫保护技术。
但无论如何,这项突破至少说明,人体胃组织确实可以被重编程为可改善血糖的胰岛素细胞来源,这项技术的发展路线可行且具有实用前景。
06 总结
人类胃类器官在体内产生功能性胰岛素细胞的意义,远超一个单纯的概念验证。它指向未来糖尿病治疗的三重革新:
器官来源革新:不再依赖胰腺可再生性极低的组织,而转向更易采集、更新快的胃黏膜。
治疗模式革新:从体外细胞培养—移植系统,转向体内直接重编程。
成本结构革新:自体化带来更低成本,也让个体化治疗变得可量产。
过去十年,类器官从“模型”变成“疗法候选”,而胃类器官重编程路线则进一步展示了器官工程带来的治疗可能性。未来如果能解决递送方式、免疫保护与安全性控制,这将为数以百万计需要胰岛素替代的患者带来新的希望。
近岸蛋白相关产品
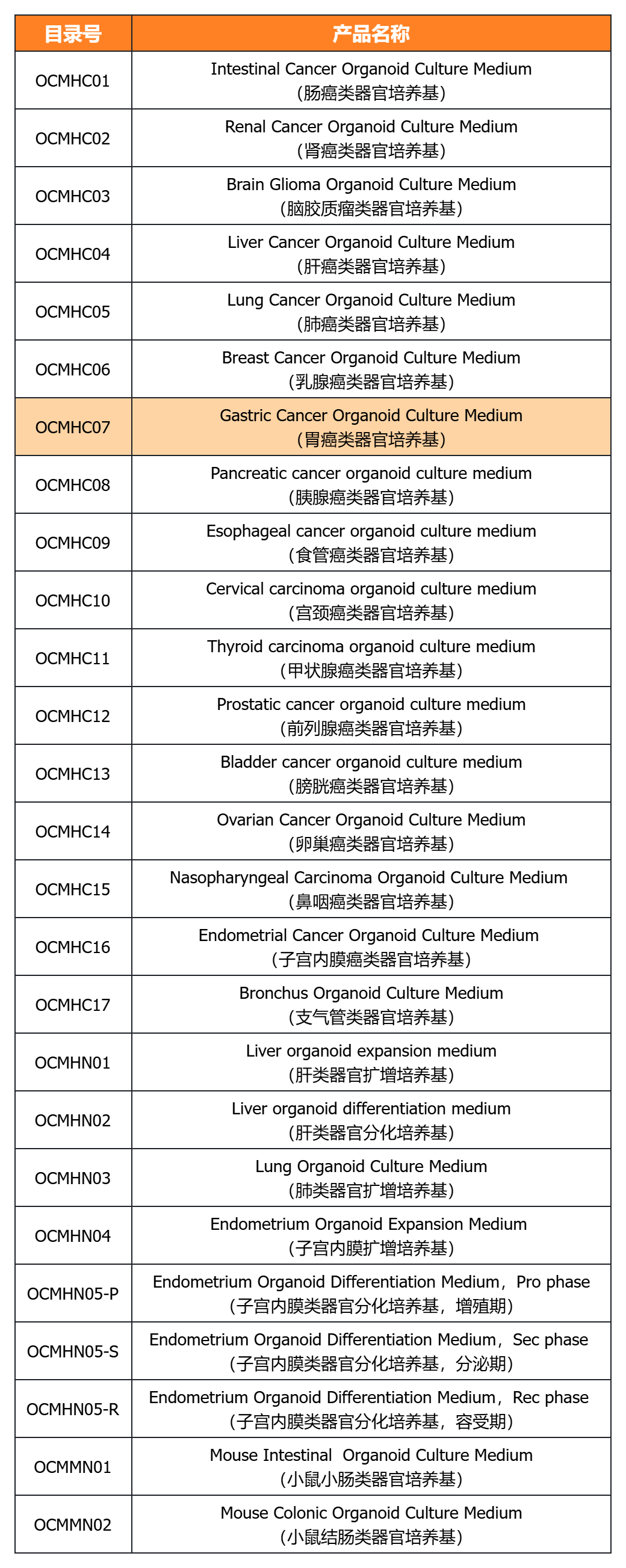
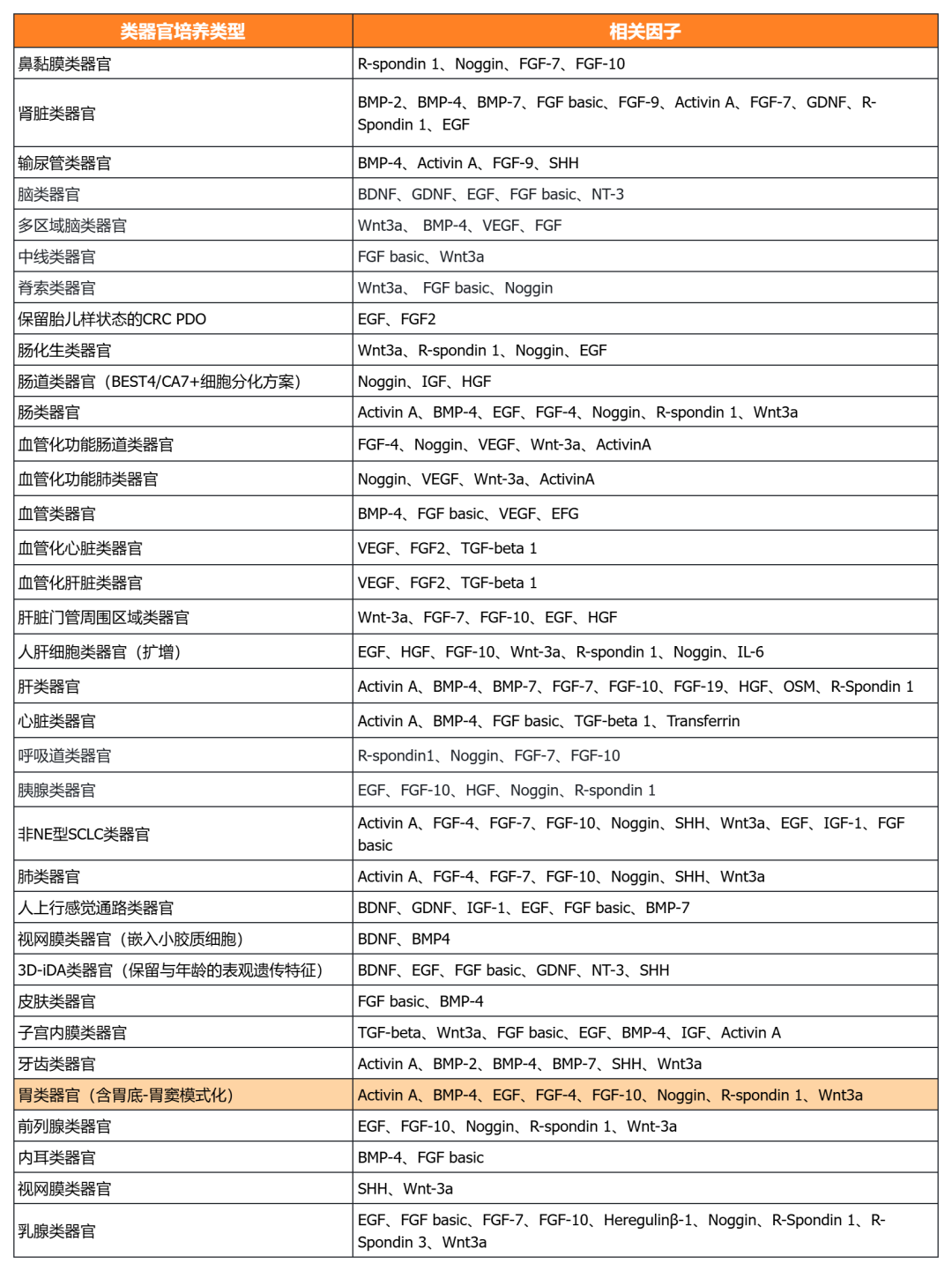
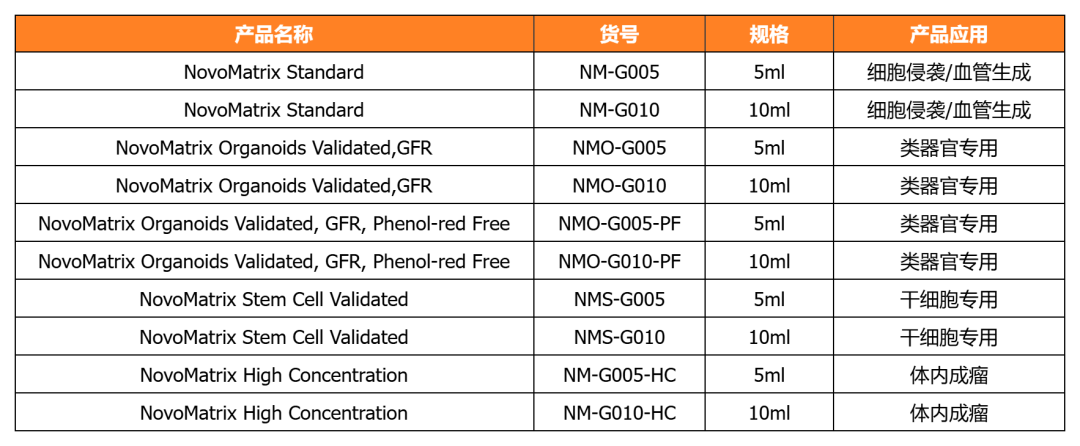
近岸蛋白提供多种类器官体外培养全方案,包括基质胶、培养基、相关细胞因子等:
经类器官培养验证的完全培养基
经类器官培养验证的细胞因子
NovoMatrix 基质胶
扫码添加小编,加入类器官培养交流群
技术支持答疑解惑,前沿进展定期分享

👆扫码添加小编微信,请备注单位姓名
参考资料
Lu J, Kim H, Zhu J, et al. Modeling in vivo induction of gastric insulin-secreting cells using transplanted human stomach organoids. Stem Cell Reports. Published online November 6, 2025. doi:10.1016/j.stemcr.2025.102708
